 Salud
Salud
Con más de 400 participantes inscritos y con la colaboración del Gobierno de Estados Unidos, se dio inicio a la fase 1 y 2 del ensayo clínico que busca encontrar la vacuna para frenar la pandemia.
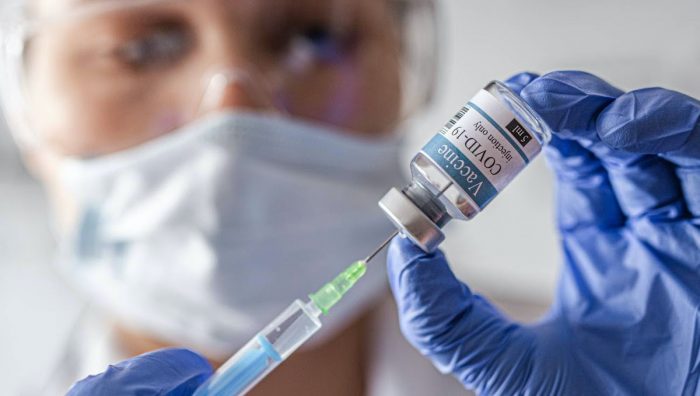
En la carrera por encontrar la vacuna contra el Covid-19 se encuentran diversos laboratorios y empresas a nivel mundial. Sanofi y GlaxoSmithKline (GSK) decidieron unirse en este proceso, utilizando tecnologías ya comprobadas en la fabricación de vacunas de otras enfermedades.
El pasado 3 de septiembre, las farmacéuticas iniciaron en conjunto el ensayo clínico de fase 1 y 2 para su vacuna contra Covid-19. Esta utiliza tecnología basada en proteína recombinante, utilizada actualmente por Sanofi para combatir la influenza, junto con un adyuvante fabricado por la empresa GSK.
Desde Sanofi explicaron que la colaboración con la empresa británica permitiría aumentar el número de dosis disponibles al utilizar ambas tecnologías. “Estamos explorando el uso de un adyuvante en esta vacuna con el fin de estimular aún más la respuesta inmunológica. El uso de un adyuvante también podría reducir la cantidad de antígeno necesario en una dosis de vacuna, lo que nos permite aumentar el número de dosis”, indicó Judith Armoni, directora médica para Sanofi Pasteur en Cono Sur.
Judith Armoni detalló que la vacuna de proteína recombinante, que actualmente se encuentra en su etapa clínica, busca producir grandes cantidades de antígenos SARS-CoV- 2 para estimular el sistema inmunológico, mezclando las secuencias de ADN que codifican los antígenos del coronavirus, con la tecnología que actualmente se utilizan contra la influenza.
La información genética de la proteína S es la base de vacuna, la cual se utiliza como antígeno, estimulando al cuerpo a producir anticuerpos. Esta tecnología ya ha sido probada en otras vacunas, siendo esta su ventaja. Además, no existen posibilidades de causar una enfermedad con esta, siendo similares sus efectos adversos a la mayoría de las vacunas gripales.
“La tecnología involucrada puede acelerar los procesos de producción. La tecnología recombinante reprograma bacterias para la producción de elementos del virus que no generan enfermedad pero permite activar la respuesta inmune de quien recibe la vacuna. De este modo el organismo está preparado para reconocer el virus apenas ingresa al organismo y detener su proceso patológico”, especificó Cristian Paredes, químico farmacéutico clínico y profesor de la Universidad Católica.
Esta técnica se está utilizando bastante en el desarrollo de fármacos y últimamente en vacunas, según especificó Paredes.“Últimamente en vacunas como la de la influenza, ha demostrado su seguridad y utilidad. Otro factor que vuelve útil este tipo de vacunas, es que no se ocupan insumos de origen animal como el huevo por lo que disminuye el requerimiento de estos y potencialmente disminuye el riesgo de alergias”.
La certificación de las vacunas consta de un proceso preclínico y otro clínico, el cual está dividido en 3 fases. Cada una de estas etapas evalúa diferentes aspectos, aumentando la cantidad de población participante a medida que se avanza.
Los datos obtenidos en el proceso preclínico, basados en dos inyecciones de la vacuna recombinante con adyuvante, mostraron altos niveles de anticuerpos neutralizantes. Estos resultados son comparables a los niveles en personas que se recuperaron del virus Covid- 19. A finales de este año se espera estén publicados los resultados de este proceso.
El ensayo clínico en el que están trabajando conjuntamente Sanofi y GSK, da inicio a la etapa clínica de la vacuna. “El ensayo clínico de fase 1-2 tiene como objetivo enrolar a 440 adultos sanos en 11 sitios en los Estados Unidos para evaluar la seguridad, la tolerabilidad y la respuesta inmune a la vacuna candidata contra Covid-19”, detalló Judith Armoni.
A partir de diciembre, según indicó la directora médica para Sanofi Pasteur en Cono Sur, se podría comenzar la fase 3 del ensayo clínico. “Comenzamos nuestro estudio de fase 1-2 en septiembre con el objetivo de realizar ensayos clínicos a gran escala (Fase 3) a partir de diciembre de 2020 y tener las dosis disponibles para abril-mayo de 2021. Con estas fases, se espera obtener datos de que la vacuna es segura, bien tolerada y produce una respuesta inmune adecuada, si estos parámetros se van cumpliendo se avanzará en las siguientes fases”.
Solicitar la aprobación regulatoria en la primera mitad del 2021, es el plan que tienen las compañías. Para lograr esto los resultados de las fases 1 y 2 deben estar listos a principios de diciembre, para posteriormente dar inicio a la última etapa previa a la solicitud de la licencia.
En cuanto al proceso de distribución, solo puede comenzar posterior al cumplimento de las tres fases clínicas y debe contar con la autorización de la entidad reguladora de cada país, que en el caso de Chile es el Instituto de Salud pública (ISP). «La autorización de uso poblacional requerirá la especificación sobre qué grupo dentro de la población la vacuna cumplió con los estudios, seguridad e inmunogenicidad”, comentó Magdalena Bastías, epidemióloga y académica de la Facultad de Medicina de la Universidad de los Andes.
«Otros aspectos a considerar previo a la incorporación de cualquier vacuna al esquema nacional de vacunación o en forma de campaña de vacunación, es que pase por el proceso habitual de incorporación”, agregó.
Para el primer semestre del 2021 se espera esté disponible la vacuna desarrollada por GSK y Sanofi. Simultáneamente al desarrollo del ensayo clínico, ambos laboratorios se encuentran aumentando la fabricación del antígeno y adyuvante, para con ello poder disponer de hasta mil millones de dosis apenas tengan la autorización para la distribución.
Adicional a la vacuna que está desarrollando junto a GSK, el laboratorio Sanofi se encuentra elaborando una segunda candidata, formada por una asociación entre Translate Bio y ARN mensajero, este último configurándose entre los más prometedores.